Медицинские изделия играют важную роль в современной медицине, предоставляя врачам и пациентам широкий спектр инструментов и устройств для лечения, диагностики и профилактики заболеваний. Однако, не все медицинские изделия могут быть свободно продаваемыми на рынке. Государственная регистрация медицинских изделий является обязательным требованием для их использования в России.
Государственная регистрация медицинских изделий проводится с целью обеспечения безопасности и эффективности применения данных изделий. При этом, требования к регистрации могут варьироваться в зависимости от категории изделия. Вообще, в России существует три категории медицинских изделий: изделия, представляющие низкий потенциальный риск, изделия среднего потенциального риска и высокорисковые изделия.
Для прохождения государственной регистрации медицинского изделия, необходимо соблюдать ряд обязательных требований. Во-первых, изделие должно быть технически и медицински безопасным, то есть не представлять повышенного риска для здоровья пациентов и медицинского персонала. Во-вторых, оно должно соответствовать имеющимся стандартам качества и безопасности. Также, для регистрации медицинского изделия необходимо предоставить всю необходимую документацию, подтверждающую его безопасность и эффективность.
Общая информация
Государственная регистрация медицинских изделий является обязательным этапом перед началом их производства, ввоза, эксплуатации и обращения на рынке Российской Федерации. Главная цель регистрации – обеспечить безопасность и эффективность медицинских изделий для защиты здоровья и жизни потребителей.
Регистрация проводится Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) и выполняется согласно требованиям Федерального закона "О государственном регулировании в сфере производства и обращения медицинских изделий".
Важно отметить, что регистрацию необходимо пройти как для новых медицинских изделий, так и для уже имеющихся на рынке, которые не были ранее зарегистрированы.
Медицинское изделие считается зарегистрированным и имеет право на обращение на рынок Российской Федерации только после успешного прохождения процедуры государственной регистрации.
Государственная регистрация подразделяется на административную и экспертную часть. Административная регистрация включает в себя проверку заявления, полноту представленной документации, сроки, необходимые для проведения экспертизы и др. Экспертная часть включает в себя оценку безопасности, эффективности, качества и соответствия медицинского изделия требованиям нормативных документов.
Процедура государственной регистрации медицинских изделий включает в себя выпуск регистрационного удостоверения, выдачу серийного номера и указание на упаковке медицинского изделия регистрационной информации.
Значение государственной регистрации
Государственная регистрация является важным этапом в процессе введения медицинских изделий на рынок. Эта процедура имеет несколько значимых аспектов:
- Правовая защита. Государственная регистрация позволяет изделию получить законную защиту со стороны государства. Регистрация устанавливает точные правила и требования, которые следует соблюдать при разработке, производстве и использовании медицинских изделий.
- Обеспечение безопасности. Регистрация обеспечивает проверку качества и безопасности медицинских изделий перед их выпуском на рынок. Система государственной регистрации включает в себя испытания и экспертизы, которые направлены на выявление возможных рисков и определение соответствия изделий установленным требованиям.
- Контроль над рынком. Государственная регистрация позволяет государству контролировать предложение и качество медицинских изделий на рынке. Регистрация способствует ограничению незаконного оборота поддельных и некачественных изделий, что обеспечивает безопасность и доверие потребителей к медицинским изделиям.
- Информационная прозрачность. Государственная регистрация позволяет создать общедоступную базу данных, в которой содержится информация о зарегистрированных медицинских изделиях. Это облегчает доступ к информации для медицинских работников, потребителей и других заинтересованных сторон.
- Стимулирование развития индустрии. Государственная регистрация способствует развитию медицинской промышленности и стимулирует инновационные разработки. Регистрация позволяет компаниям внедрять новые технологии и методы, что в итоге способствует улучшению качества медицинской помощи и удовлетворению потребностей пациентов.
Таким образом, государственная регистрация медицинских изделий играет важную роль в обеспечении безопасности и качества медицинской помощи, контроле рынка и стимулировании развития индустрии. Эта процедура содействует защите интересов потребителей и общества в целом.
Основания для государственной регистрации

Государственная регистрация медицинских изделий является обязательной процедурой в России. Она проводится на основании ряда законодательных актов и правил, устанавливающих требования к безопасности и эффективности медицинских изделий.
Основными основаниями для государственной регистрации медицинских изделий являются:
- Законодательство. Регистрация проводится в соответствии с Федеральным законом "О государственном регулировании производства и оборота медицинских изделий". Данный закон устанавливает обязательные требования к качеству, безопасности и эффективности медицинских изделий, а также порядок их регистрации.
- Соблюдение стандартов. Медицинские изделия должны соответствовать требованиям ГОСТ и техническим регламентам, определяющим правила и методы испытаний на безопасность и эффективность.
- Клинические испытания. Перед государственной регистрацией медицинские изделия должны пройти клинические испытания, которые позволяют оценить их безопасность и эффективность при использовании на практике. Результаты испытаний должны быть подтверждены соответствующими документами.
- Расширенная апробация. В некоторых случаях проводятся расширенные испытания медицинских изделий, которые включают более детальное изучение их характеристик и производственного процесса.
- Анализ данных. Для государственной регистрации требуется представление обоснования эффективности и безопасности изделия на основе данных, полученных в процессе клинических исследований, а также результатов экспертиз и лабораторных испытаний.
- Производительская практика. Ответственные лица и производители медицинских изделий должны выполнять требования, установленные законодательством, в частности относительно производственных процессов, контроля качества и надлежащих практик производства.
Весь процесс государственной регистрации и оценки медицинских изделий основывается на научно-обоснованных принципах и требованиях к безопасности и эффективности, направленных на защиту здоровья пациентов и потребителей.
Законодательные акты
Деятельность по государственной регистрации медицинских изделий регулируется рядом законодательных актов. Эти акты устанавливают требования и процедуры, которые компании должны соблюдать при подаче заявки на регистрацию медицинского изделия.
Наиболее важными законодательными актами в данной области являются:
- Федеральный закон "О государственном регулировании разработки, производства и оборота медицинских изделий" от 21 декабря 2010 года № 323-ФЗ. В этом законе регламентируются основные положения о регистрации медицинских изделий, включая определение медицинского изделия, требования к качеству и безопасности, процедуры регистрации и перерегистрации.
- Положение "Об утверждении правил государственной регистрации медицинских изделий" (Постановление Правительства РФ от 12 декабря 2012 года № 1416). В этом положении устанавливаются конкретные процедуры и требования для подачи заявки на регистрацию медицинского изделия, а также процедуры проверки и экспертизы заявки.
- Федеральный закон "О техническом регулировании" от 27 декабря 2002 года № 184-ФЗ. В этом законе определяются основные принципы и общие требования к продукции, включая медицинские изделия. Он также устанавливает требования к документации, маркировке и обозначению медицинского изделия.
Компании, желающие зарегистрировать медицинское изделие, должны тщательно ознакомиться с требованиями этих законодательных актов и следовать им при подготовке и подаче заявки на регистрацию. Нарушение требований законодательства может привести к отклонению заявки и препятствовать получению регистрационного разрешения на медицинское изделие.
Международные стандарты

Международные стандарты играют важную роль в гарантировании качества и безопасности медицинских изделий. Они устанавливают общепризнанные требования и рекомендации, которым должны соответствовать производители, чтобы получить государственную регистрацию своих продуктов.
Одним из основных международных организаций, занимающихся созданием стандартов для медицинских изделий, является Международная организация по стандартизации (ISO). Многие страны придерживаются стандартов ISO при регулировании регистрации медицинских изделий.
ISO 13485 - это стандарт, устанавливающий требования к системе менеджмента качества для производителей медицинских изделий. В соответствии с данным стандартом, производители должны разработать и внедрить систему качества, которая удовлетворяет требованиям ISO 13485 и подтверждается соответствующим сертификатом.
ISO 14971 - это стандарт, устанавливающий требования к оценке рисков медицинских изделий. Он определяет процесс оценки и управления рисками в течение всего жизненного цикла медицинского изделия. Оценка рисков позволяет определить потенциальные опасности, связанные с использованием изделия, и разработать соответствующие меры для минимизации этих рисков.
Кроме ISO, существуют и другие международные стандарты, которые могут быть применимы к регистрации медицинских изделий. Например, IEC 60601 устанавливает требования безопасности и электромагнитной совместимости для медицинской электронной аппаратуры.
В регулировании медицинских изделий также широко используется международная классификация медицинских изделий (МКМИ), разработанная Всемирной организацией здравоохранения (ВОЗ). МКМИ позволяет классифицировать медицинские изделия в зависимости от их назначения и потенциального риска для пациентов.
| Класс | Описание | Примеры изделий |
|---|---|---|
| Класс I | Низкий риск | Термометры, перевязочные материалы |
| Класс IIa | Низкий риск среднего потенциала | Хирургические инструменты, шприцы |
| Класс IIb | Средний риск | Имплантаты, гемодиализные системы |
| Класс III | Высокий риск | Искусственные сердечные клапаны, кардиостимуляторы |
Международные стандарты и классификация медицинских изделий помогают государственным органам контроля и регулирования установить единые требования для производителей и обеспечить безопасность и эффективность медицинских изделий для пациентов.
Категории медицинских изделий
Медицинские изделия делятся на несколько категорий в зависимости от их потенциальной опасности и новизны:
Категория I - это медицинские изделия, которые имеют низкий потенциал риска для пациентов и обычно являются хорошо изученными и утвержденными. Представители этой категории могут включать инвазивные медицинские инструменты, такие как шприцы и одноразовые иглы.
Категория IIa - включает среднерисковые медицинские изделия, которые могут иметь ограниченные риски для здоровья пациентов. Эти изделия могут включать медицинские аппараты, такие как электрокардиографы и медицинские приборы, используемые для диагностики и мониторинга пациентов.
Категория IIb - представляет медицинские изделия, которые имеют значительный риск для здоровья пациентов и требуют повышенного контроля и оценки безопасности. В эту категорию могут входить медицинские имплантаты, такие как искусственные суставы и стенты, а также некоторые виды инвазивных медицинских инструментов.
Категория III - включает медицинские изделия, которые представляют самый высокий уровень риска для здоровья пациентов. Эти изделия включают в себя сложные импланты и некоторые лекарственные разработки, требующие серьезной оценки и испытаний перед использованием.
Все медицинские изделия, независимо от классификации, должны пройти государственную регистрацию и получить соответствующее разрешение на использование.
Имплантаты
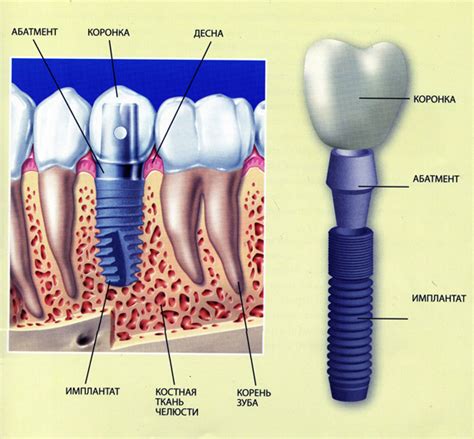
Имплантаты - это медицинские изделия, предназначенные для внедрения в организм пациента и замещения или восстановления функций поврежденных тканей, органов или систем организма. Они широко применяются в различных областях медицины, включая стоматологию, ортопедию, кардиологию и пластическую хирургию.
Имплантаты должны проходить государственную регистрацию в России, чтобы быть разрешенными к использованию. Для этого необходимо соблюдение определенных требований и прохождение процедуры регистрации уполномоченными органами.
В процессе государственной регистрации имплантатов оценивается их безопасность и эффективность. Производители должны предоставить полную информацию о составе материалов, из которых сделан имплантат, а также данные о его дизайне, изготовлении, стерилизации и планировании эксплуатации.
Важным аспектом государственной регистрации является проведение клинических испытаний, которые позволяют оценить безопасность и эффективность имплантата в реальных условиях использования. Испытания проводятся на определенном количестве пациентов и включают наблюдение за их состоянием после внедрения имплантата.
При государственной регистрации имплантатов также учитываются международные стандарты и рекомендации. Если имплантат уже прошел регистрацию в других странах или получил сертификаты соответствия качеству, это может существенно упростить процесс его регистрации в России.
После успешной государственной регистрации имплантат может быть использован медицинскими учреждениями при оказании медицинской помощи пациентам. Однако важно помнить, что государственная регистрация является только одним из этапов в общем процессе обеспечения качества и безопасности медицинских изделий.
Аппараты и приборы
Аппараты и приборы - это одна из групп медицинских изделий, требующих государственную регистрацию. Эти изделия служат для проведения диагностики, терапии и контроля состояния пациента.
Для государственной регистрации аппаратов и приборов необходимо предоставить следующую документацию:
- Заявление о государственной регистрации;
- Техническую документацию на изделие;
- Результаты испытаний, подтверждающие безопасность и эффективность изделия;
- Сертификат соответствия стандартам качества;
- Декларацию соответствия требованиям Таможенного союза;
- Сведения о производителе и поставщике изделия.
Также, при государственной регистрации аппаратов и приборов, учитываются следующие требования:
- Изделие должно соответствовать требованиям безопасности, установленным законодательством;
- Качество и эффективность изделия должны быть подтверждены результатами испытаний;
- Производитель должен предоставить гарантии качества и безопасности изделия;
- Документы, подтверждающие соответствие изделия требованиям Таможенного союза, должны быть предоставлены.
Государственная регистрация аппаратов и приборов необходима для обеспечения безопасности и качества медицинской техники, а также для контроля за ее производством и использованием. После прохождения государственной регистрации изделие получает свидетельство о государственной регистрации, которое подтверждает его законность и соответствие требованиям.
В случае выявления нарушений требований государственной регистрации, производитель аппарата или прибора может быть привлечен к административной или уголовной ответственности, а изделие может быть изъято с рынка и запрещено к использованию.
Медицинские расходные материалы
Медицинские расходные материалы – это изделия, предназначенные для однократного использования в медицинских учреждениях. Они играют важную роль в обеспечении безопасности и эффективности медицинской помощи пациентам.
Медицинские расходные материалы включают в себя широкий спектр изделий, таких как:
- Шприцы и иглы;
- Перчатки;
- Маски и респираторы;
- Повязки и бинты;
- Инфузионные системы;
- Мочеприемники и дренажные системы;
- Стерильные компрессы;
- Электроды и электродные пластыри;
- Пластыри и лейкопластыри;
- И многое другое.
Государственная регистрация медицинских расходных материалов осуществляется в соответствии с законодательством Российской Федерации. Для прохождения регистрации требуется предоставить полное и достоверное досье с документацией о безопасности и эффективности продукта.
В документации должны быть указаны следующие данные:
- Название и описание продукта;
- Технические характеристики и спецификации продукта;
- Данные о производителе, включая контактные данные;
- Результаты клинических и лабораторных исследований, если они проведены;
- Данные о сертификации и соответствии стандартам качества;
- Инструкция по применению, подробные описания способов использования и хранения продукта;
- Сведения о сроке годности и условиях хранения;
- Данные об упаковке и маркировке продукта;
- Информация о возможных побочных эффектах или осложнениях, связанных с использованием продукта;
- Информация о классификации и регулировании продукта;
- Другая необходимая информация.
Государственная регистрация медицинских расходных материалов обеспечивает контроль и надзор за качеством и безопасностью этих изделий на рынке медицинских товаров. Она гарантирует, что расходные материалы соответствуют установленным стандартам и не представляют угрозы для здоровья пациентов и медицинского персонала.
При выборе медицинских расходных материалов следует обращать внимание на их сертификацию и соответствие стандартам. Такие изделия должны быть отмечены специальными знаками качества и маркировкой, указывающей на их регистрацию в установленном порядке.
Важно понимать, что использование несертифицированных или некачественных расходных материалов может привести к неблагоприятным последствиям в медицинской практике. Поэтому уделяйте особое внимание выбору и приобретению медицинских расходных материалов.
Требования для государственной регистрации
Государственная регистрация медицинских изделий является обязательным этапом перед их введением в обращение. В России данный процесс регулируется Федеральным законом "О медицинских изделиях".
Для успешной государственной регистрации медицинского изделия необходимо выполнение ряда требований, которые включают:
- Испытания и исследования:
- Проведение клинического исследования медицинского изделия на определенном числе пациентов с целью определения его эффективности и безопасности.
- Проведение лабораторных испытаний для проверки соответствия медицинского изделия требованиям по безопасности, электромагнитной совместимости, стерилизации и другим параметрам.
- Составление технического досье, которое включает в себя информацию о характеристиках продукта, результаты клинических и лабораторных исследований, инструкции по применению и др.
- Составление заявления на государственную регистрацию и предоставление всех необходимых документов и заключений экспертных организаций.
- Производство медицинских изделий должно осуществляться на соответствующем производственном оборудовании и в соответствии с требованиями ГОСТов и стандартов.
- Реализация системы управления качеством, которая включает контроль качества сырья и комплектующих, контроль процесса производства и контроль качества готовой продукции.
- Обязательная маркировка медицинских изделий, которая должна содержать информацию о производителе, инструкции по применению, сроке годности и других требованиях.
- Упаковка медицинских изделий должна обеспечивать их сохранность и защиту от внешних воздействий.
Таким образом, государственная регистрация медицинских изделий требует выполнения ряда требований, связанных с испытаниями, документацией, производством и контролем качества, а также с маркировкой и упаковкой продукта.
Клинические испытания
Клинические испытания - это этап в процессе государственной регистрации медицинских изделий, который предпринимается для определения их безопасности и эффективности. Эти испытания проводятся на людях и являются важным шагом перед внедрением нового медицинского изделия на рынок.
Основная цель клинических испытаний - получить достоверные данные о безопасности и эффективности медицинского изделия. Испытания проводятся в соответствии с протоколом, который определяет цели и методы исследования, а также критерии оценки результатов.
Перед началом клинических испытаний необходимо получить разрешение соответствующих органов контроля и надзора. Их задача - проверить протокол и убедиться, что испытания будут проведены в соответствии с международными стандартами и этическими принципами.
В процессе клинических испытаний участвуют пациенты, которые добровольно соглашаются на участие и дают информированное согласие. Их состояние и реакция на новое медицинское изделие тщательно отслеживаются и документируются в течение определенного периода времени.
Результаты клинических испытаний анализируются и оцениваются специалистами, а затем представляются органам контроля и надзора для рассмотрения заявки на регистрацию медицинского изделия. По результатам обследования и анализа данных, органы контроля и надзора принимают решение о допуске медицинского изделия на рынок или его отказе.
Клинические испытания являются важным этапом в процессе государственной регистрации медицинских изделий. Они позволяют убедиться в безопасности и эффективности медицинского изделия перед его внедрением в медицинскую практику.
Лабораторные исследования
Лабораторные исследования являются важной составляющей медицинской диагностики и контроля состояния пациента. Они позволяют определить наличие и уровень различных биологических компонентов в организме, а также выявить наличие патологий и оценить эффективность лечения.
Для осуществления лабораторных исследований используются различные медицинские изделия, такие как анализаторы, реагенты, контрольные материалы и другие. Все эти изделия должны пройти государственную регистрацию для обеспечения безопасности и качества их использования.
Государственная регистрация лабораторных медицинских изделий проводится в соответствии с требованиями законодательства и нормативно-технической документацией в области медицинского обеспечения. Для получения разрешительной документации, производитель должен соответствовать следующим требованиям:
- Предоставить информацию о химическом и физическом составе изделия, его свойствах и принципе действия.
- Доказать безопасность и эффективность использования изделия.
- Подтвердить соответствие изделия требованиям стандартов качества и безопасности.
- Получить положительное заключение экспертного центра о возможности применения изделия в медицинской практике.
После успешной государственной регистрации, лабораторные медицинские изделия получают свидетельство о государственной регистрации и могут быть использованы в медицинских учреждениях.
Важно отметить, что лабораторные исследования должны проводиться врачом-лаборантом или другим квалифицированным специалистом, который имеет достаточные знания и опыт в данной области. Результаты лабораторных исследований являются дополнительной информацией для врача при постановке диагноза и выборе метода лечения.
| Преимущества лабораторных исследований: | Недостатки лабораторных исследований: |
|---|---|
|
|
Декларация соответствия

Декларация соответствия – это документ, который подтверждает соответствие медицинского изделия требованиям технического регламента, установленным для этой категории изделий. Декларация соответствия является одним из основных документов при государственной регистрации медицинских изделий.
В декларации соответствия указывается информация о производителе изделия, наименование и описание изделия, а также требования, которым оно соответствует. Также в декларации должны быть указаны результаты испытаний изделия на соответствие установленным требованиям.
Декларация соответствия является обязательным документом для получения разрешения на ввоз и обращение медицинского изделия на рынке. Она является основанием для подачи заявки на государственную регистрацию, а также для получения сертификата соответствия.
Для получения декларации соответствия требуется предоставить следующие документы:
- Заявление на государственную регистрацию медицинского изделия.
- Техническое описание медицинского изделия.
- Результаты испытаний изделия.
- Документацию, подтверждающую качество производства и соответствие изделия обязательным требованиям.
Декларация соответствия имеет ограниченный срок действия и требует периодического обновления. В случае изменения конструкции изделия, технологии его производства или требований к нему, необходимо произвести переоформление декларации соответствия.
Декларация соответствия является важным документом для обеспечения безопасности и качества медицинских изделий. Она гарантирует, что изделие прошло необходимые испытания и соответствует требованиям, установленным законодательством и стандартами.
Вопрос-ответ
Какие медицинские изделия должны пройти государственную регистрацию?
Государственной регистрации должны подвергаться все медицинские изделия, которые предназначены для использования на территории России и имеют медицинское назначение.
Каковы требования к медицинским изделиям, проходящим государственную регистрацию?
Медицинские изделия, проходящие государственную регистрацию, должны соответствовать требованиям федеральных законов, нормативных правовых актов и технических регламентов, а также иметь полную документацию, подтверждающую их безопасность, эффективность и качество.
Как происходит государственная регистрация медицинских изделий?
Государственная регистрация медицинских изделий проходит через Федеральную службу по надзору в сфере здравоохранения и социального развития (Росздравнадзор). Заявитель предоставляет полный пакет документов, включая сведения о медицинском изделии, его маркировку, результаты клинических испытаний и др. После рассмотрения заявления и проведения экспертизы, Федеральная служба выносит решение о государственной регистрации или отказе в ней.
Какие последствия могут быть, если медицинское изделие не прошло государственную регистрацию?
Если медицинское изделие не прошло государственную регистрацию, оно не может быть легально использовано и продано на территории России. Такое изделие может представлять опасность для здоровья и жизни пациентов, а также не может быть покрыто средствами ОМС или ДМС.
Что происходит с медицинским изделием после его государственной регистрации?
После государственной регистрации медицинское изделие получает разрешение на его использование и продажу на территории России. Заявитель может заключать контракты с медицинскими организациями для поставки и использования изделия. Однако, раз в 5 лет изделие должно пройти повторную государственную регистрацию.