Химические явления представляют собой основные процессы, которые происходят в химических реакциях. Они характеризуются изменением состава вещества, возникновением новых веществ и сопровождаются поглощением или выделением энергии.
Существует несколько видов химических явлений. Одним из них является окислительно-восстановительное (окислительно-восстановительное) реакция. В ней происходит передача электронов от одного вещества к другому. Примером такой реакции может быть горение: при сгорании дерева происходит окисление углерода и выделение энергии.
Еще одно химическое явление - гидролиз. В процессе гидролиза происходит разложение химических соединений с помощью воды. Например, при гидролизе соли натрия и хлористого алюминия возникают гидроксид натрия и оксид алюминия.
Также отдельным видом химического явления является растворение. В процессе растворения твердого вещества в жидкости происходит образование однородного раствора. Примером такой реакции может служить растворение соли в воде: при этом образуется раствор, в котором ионы натрия и хлора полностью перемешиваются с молекулами воды.
Химические явления являются важным объектом изучения в химии. Их понимание позволяет обоснованно объяснять причины и последствия химических реакций, а также применять их в практических целях, например, в синтезе новых веществ или процессах очистки воды.
Познакомившись с основными видами химических явлений и их примерами, можно лучше понять мир химии и его важность в нашей жизни.
Химические реакции
Химическая реакция - это процесс превращения одних веществ в другие под воздействием различных факторов. В результате химической реакции происходят изменения в строении и составе исходных веществ.
Химические реакции могут происходить со всеми видами веществ, будь то элементы, соединения, ионы или молекулы. Реакции могут протекать при различных условиях: при повышенной или пониженной температуре, под воздействием света, в присутствии катализаторов или при взаимодействии с другими веществами.
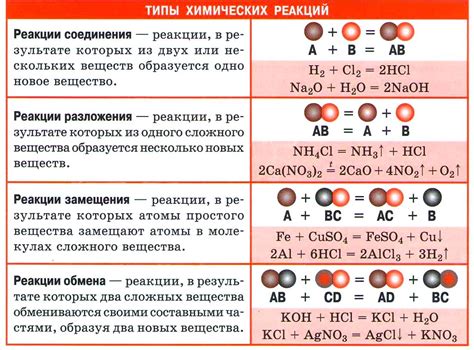
В химии выделяют разные типы химических реакций:
- Синтез (объединение) - реакция, при которой два или более вещества объединяются в одно новое вещество. Примером может служить реакция образования воды из водорода и кислорода:
- Распад - реакция, при которой одно вещество распадается на два или более более простых вещества. Примером может служить реакция распада воды на водород и кислород под воздействием электрического тока:
- Замещение - реакция, при которой одно вещество вытесняет другое из соединения. Примером может служить реакция между металлом и кислотой, при которой металл вытесняет водород из кислоты:
- Обратимая реакция - реакция, которая может протекать в обоих направлениях. В этом типе реакции образуются как продукты реакции, так и исходные вещества. Примером может служить реакция между водой и углекислым газом, при которой образуется угольная кислота, а затем распадается на воду и углекислый газ:
- Окислительно-восстановительная реакция - реакция, при которой происходит передача электронов между веществами. Одно вещество, окислитель, получает электроны, а другое вещество, восстановитель, отдает электроны. Примером может служить реакция горения:
| 2H2 + O2 | → | 2H2O |
| 2H2O | → | 2H2 + O2 |
| Zn + 2HCl | → | ZnCl2 + H2 |
| H2O + CO2 | → | H2CO3 |
| H2CO3 | → | H2O + CO2 |
| С3Н8 + 5O2 | → | 3CO2 + 4H2O |
Химические реакции играют важную роль во всех областях науки и техники. Они позволяют получать новые вещества, производить энергию, синтезировать лекарства и многое другое.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) — это химические реакции, которые происходят между веществами, где одно вещество окисляется (теряет электроны), а другое вещество восстанавливается (получает электроны). ОКР являются одним из основных типов химических реакций и имеют широкое применение в различных процессах, включая промышленность, биологию и электрохимию.
ОВР могут происходить как в растворе, так и в твердом состоянии. Важными понятиями в рамках ОВР являются окислитель (вещество, окисляющее другое вещество) и восстановитель (вещество, восстанавливающее другое вещество).
Процессы ОВР можно классифицировать на несколько групп:
- Аналитические ОВР: такие реакции используются для определения содержания определенного вещества в растворе или смеси. Например, реакция окисления перманганата калия может быть использована для определения концентрации железа в пробе.
- Синтетические ОВР: такие реакции используются для синтеза различных веществ. Например, реакция окисления металла алюминия может быть использована для получения оксида алюминия.
- Электрохимические ОВР: такие реакции происходят в электрохимических ячейках, где электроны переносятся через внешнюю цепь. Одним из известных примеров электрохимической реакции является реакция в батарее, где происходит окисление и восстановление веществ на электродах.
Примером ОВР может быть реакция между железом и кислородом:
| Вещество | Окисление | Восстановление |
|---|---|---|
| Железо (Fe) | Fe -> Fe3+ + 3e- | |
| Кислород (O2) | O2 + 4e- -> 2O2- |
В данном примере, железо окисляется до иона железа Fe3+, теряя 3 электрона, а кислород восстанавливается до иона оксид-иона O2-, получая 4 электрона.
Гидролиз

Гидролиз — это химическая реакция, при которой вещество взаимодействует с водой, приводя к образованию новых веществ. Гидролиз может протекать как в кислой, так и в щелочной среде.
Гидролиз в кислой среде происходит при добавлении воды к соли. В результате водородные ионы (H+) от воды замещают катионы металла в соли, образуя соответствующую кислоту. Анионы переходят в свободный анионный радикал. Например:
| Соль | Реакция гидролиза в кислой среде |
|---|---|
| NaCl (хлорид натрия) | NaCl + H2O → HCl + NaOH |
| FeCl3 (хлорид железа) | FeCl3 + 3H2O → 3HCl + Fe(OH)3 |
Гидролиз в щелочной среде происходит при добавлении воды к соли, в которой анион может образовывать гидроксидное основание. В результате водородные ионы от воды замещают анионы, образуя гидроксид. Катионы переходят в свободный катионный радикал. Например:
| Соль | Реакция гидролиза в щелочной среде |
|---|---|
| NaCH3COO (ацетат натрия) | NaCH3COO + H2O → CH3COOH + NaOH |
| CuSO4 (сульфат меди) | CuSO4 + H2O → H2SO4 + Cu(OH)2 |
Гидролиз имеет большое значение в химии и используется в различных процессах и реакциях. Он может приводить как к образованию кислот, так и к образованию оснований, а также может изменять характерное pH растворов.
Комплексообразование
Комплексообразование – это химическое явление, при котором между частицами вещества образуются сложные структуры – комплексы. Комплексные соединения проявляют свои специфические свойства, отличающиеся от свойств исходных веществ.
Основными участниками комплексообразования являются лиганды и центральные ионы. Лиганды – это атомы, ионы или молекулы, которые могут формировать ковалентные или координационные связи с центральными ионами. Центральные ионы – это ионы металлов, которые образуют связи с лигандами.
Примеры комплексообразования включают следующие процессы:
- Образование солей с координационными соединениями. Например, образование купрата из меди(II) и аммиака: Cu(II) + 4 NH3 → [Cu(NH3)4]2+.
- Образование оксоанионов. Например, образование ферроцианида из феррия и цианида: Fe(III) + 6 CN- → [Fe(CN)6]3-.
- Образование комплексных соединений для стабилизации центральных ионов. Например, образование хлорофилла, который содержит центральный ион магния (Mg2+) в окружении лигандов хлорофиллинов.
- Образование катализаторов. Комплексообразующие ионы могут образовывать катализаторы, которые способствуют протеканию различных химических реакций. Например, соединения железа(II) могут выступать в роли катализаторов гидратации двухатомной молекулы ацетилена.
Комплексообразование является одним из важнейших явлений в химии и имеет широкое применение в различных областях, таких как медицина, сельское хозяйство, промышленность и другие.
Протолитические реакции
Протолитические реакции являются одним из видов химических реакций, включающих в себя образование или разложение ионов в результате диссоциации кислот или оснований.
В химии существуют два типа протолитических реакций: протолиз кислот и протолиз оснований.
Протолиз кислот
Протолиз кислоты — это реакция, при которой кислота передает протон (водородный ион) на воду или другое вещество. Как результат, кислота диссоциирует на водородные ионы и ионы кислотного остатка.
Пример протолиза кислоты:
- HCl + H2O → H3O+ + Cl-
- HNO3 + H2O → H3O+ + NO3-
Протолиз оснований
Протолиз основания — это реакция, при которой основание принимает протон (водородный ион) из воды или другого вещества. Как результат, основание диссоциирует на гидроксидный ион и ионы основного металла.
Пример протолиза основания:
- NaOH + H2O → Na+ + OH-
- KOH + H2O → K+ + OH-
Протолитические реакции являются основой для понимания кислотно-основного равновесия и реакций растворения в химии.
Необратимые реакции
Необратимая химическая реакция – это реакция, которая происходит в таком направлении, что продукты реакции не могут обратно превратиться в исходные вещества. В отличие от обратимых реакций, которые могут происходить как в прямом, так и в обратном направлении, необратимые реакции происходят только в одном направлении.
Примеры необратимых реакций:
- Горение. При горении вещества окисляются и превращаются в новые вещества с выделением энергии в виде тепла и света. Примерами горения могут служить горение древесины, бумаги, газа.
- Реакции разложения. В ходе реакций разложения вещества разлагаются на более простые компоненты. Например, электролиз воды приводит к разложению воды на кислород и водород.
- Образование осадка. В некоторых реакциях образуются не растворимые вещества, которые выпадают в осадок. Например, при смешении раствора соляной кислоты и раствора хлорида натрия образуется осадок хлорида серебра.
- Разрыв пищеводной жгута в организме. Реакции в организме также могут быть необратимыми. Например, в процессе пищеварения пищеводный жгут разрывается для переваривания пищи, и это является необратимой реакцией.
Это лишь некоторые примеры необратимых реакций в природе и в химической лаборатории. Каждая отдельная реакция имеет свои уникальные условия, при которых она происходит и необратимо приводит к образованию новых веществ.
Растворы и их свойства

Раствор - это гомогенная система, состоящая из растворителя (среды, в которой происходит растворение) и растворенного вещества (вещества, которое растворяется в растворителе).
В зависимости от состава растворов и их свойств, они могут быть классифицированы следующим образом:
- Слабые растворы - такие растворы, в которых концентрация растворенного вещества мала.
- Концентрированные растворы - растворы, в которых концентрация растворенного вещества высока.
- Насыщенные растворы - растворы, в которых количество растворенного вещества достигает предельной концентрации при заданной температуре.
- Перенасыщенные растворы - растворы, в которых содержится более растворимого вещества, чем при данной температуре может вместить растворитель.
Важными свойствами растворов являются:
- Растворимость - способность вещества растворяться в растворителе.
- Концентрация - количество растворенного вещества, содержащегося в растворе.
- Коллоидные свойства - способность растворов проявлять коллоидные свойства, такие как турбидность, неустойчивость, коагуляция и т. д.
- Электропроводность - способность растворов проводить электрический ток.
- Криоскопическая и термометрическая недостаточности - изменение температуры замерзания или кипения растворителя под влиянием растворенного вещества.
Все эти свойства позволяют изучать растворы и использовать их в различных областях науки и техники.
Разбавленные растворы
Разбавленные растворы - это растворы, в которых количество растворенного вещества намного меньше, чем в насыщенном растворе. Они могут быть получены путем добавления растворителя (обычно вода) к концентрированному раствору.
Разбавление раствора приводит к уменьшению его концентрации. Концентрация разбавленного раствора может быть выражена в процентах, молях, молярной доле или весовой доле. Обычно разбавленные растворы использованы для приготовления рабочих растворов, анализа и экспериментов в химической и биологической лаборатории.
Примеры разбавленных растворов:
- Разбавленный раствор соли: добавление воды к насыщенному раствору соли приводит к образованию разбавленного раствора. В разбавленном растворе концентрация соли будет ниже, чем в насыщенном растворе.
- Разбавленный раствор кислоты или щелочи: при добавлении воды к концентрированному раствору кислоты или щелочи происходит разбавление, и концентрация раствора уменьшается.
Разбавленные растворы являются важной частью химических и биологических исследований, так как они обеспечивают возможность проведения различных экспериментов с точными значениями концентрации растворов.
Таблица с примерами разбавленных растворов:
| Вещество | Разбавленный раствор |
|---|---|
| Натрий хлорид (соль) | Разбавленный раствор соли |
| Серная кислота | Разбавленный раствор кислоты |
| Калий гидроксид (щелочь) | Разбавленный раствор щелочи |
Насыщенные растворы

Насыщенные растворы - это растворы, в которых содержится максимальное количество растворенного вещества при данной температуре и давлении.
В насыщенных растворах происходит динамическое равновесие между процессом растворения и кристаллизацией вещества. Количество растворенного вещества в насыщенном растворе зависит от ряда факторов, включая температуру, давление и химическую природу вещества.
Чтобы получить насыщенный раствор, можно провести ряд экспериментов. Например, можно постепенно добавлять растворенное вещество в чистую растворяющуюся жидкость до тех пор, пока вещество перестанет растворяться и начнет оседать на дне сосуда. В этот момент насыщенный раствор будет содержать максимальное количество растворенного вещества.
Насыщенные растворы имеют ряд характеристик:
- Концентрация растворенного вещества в насыщенном растворе постоянна при заданной температуре и давлении.
- При подогревании насыщенного раствора его растворимость может увеличиваться, поскольку при повышении температуры увеличивается кинетическая энергия частиц, что способствует их лучшему разделению при растворении.
- При охлаждении насыщенного раствора его растворимость может уменьшаться, поскольку при понижении температуры частицы теряют кинетическую энергию, что затрудняет их движение и разделение при растворении.
Примером насыщенного раствора может служить раствор соли в воде. При дальнейшем добавлении соли в воду, насыщенный раствор не будет больше растворять еще соль и она будет оседать на дне сосуда.
Насыщенные растворы имеют важное применение в различных отраслях науки и промышленности. Например, они используются для получения солей, очистки отходов, изготовления лекарственных препаратов и многих других процессов.
Концентрация растворов
Концентрация растворов - это количество растворенного вещества, выраженное в относительных или абсолютных значениях.
Существуют различные способы измерения концентрации растворов:
- Массовая доля - отношение массы растворенного вещества к массе раствора. Обозначается символом μ. Например, массовая доля соли в растворе равна отношению массы соли к массе раствора и выражается в процентах (%).
- Молярность - отношение числа молей растворенного вещества к объему растворителя. Обозначается символом M. Например, молярность раствора соли равна отношению числа молей соли к объему растворителя и выражается в молях на литр (M).
- Нормальность - отношение числа геквивалентов растворенного вещества к объему растворителя. Обозначается символом N. Например, нормальность раствора кислоты равна отношению числа геквивалентов кислоты к объему растворителя и выражается в геквивалентах на литр (N).
- Объемная доля - отношение объема растворенного вещества к объему раствора. Обозначается как V/V или Vр/Vс. Например, объемная доля спирта в растворе равна отношению объема спирта к объему раствора и выражается в процентах (%).
- Плотность - отношение массы раствора к его объему. Обозначается символом ρ. Например, плотность сахарного раствора равна отношению массы раствора к его объему и выражается в г/мл.
Выбор метода измерения концентрации зависит от особенностей раствора и поставленной задачи. Корректное определение концентрации растворов является важным элементом во многих химических и физических процессах.
Плотность растворов
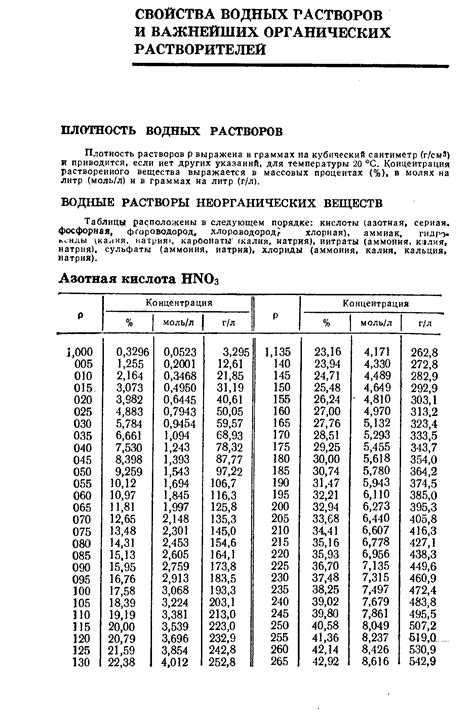
Плотность раствора - это физическая величина, которая характеризует массу растворенного вещества, содержащегося в единице объема раствора.
Плотность раствора обычно выражается в г/мл или г/см³. Она зависит от концентрации раствора и от температуры. Чем больше масса растворенного вещества содержится в единице объема раствора, тем выше плотность раствора.
Плотность раствора может быть определена экспериментально с помощью пикнометра или гидрометра. Пикнометр - это стеклянная емкость особой формы, которая позволяет определить плотность жидкости. Гидрометр - это прибор, используемый для определения плотности жидкости по силе плавучести.
Кроме экспериментального определения, плотность раствора можно рассчитать с помощью математической формулы:
Плотность раствора (г/мл) = Масса растворенного вещества (г) / Объем раствора (мл)
История измерения плотности растворов берет свое начало с древних греков и считается одним из важнейших достижений ранней химии.
Знание плотности растворов имеет множество практических применений. Например, плотность раствора позволяет оценить массу растворенных веществ при создании различных растворов или контроле качества продукции. Также плотность раствора используется при расчете дозировки препаратов, при проведении анализа веществ и в других областях.
Вопрос-ответ
Что такое химические явления?
Химические явления - это процессы, которые приводят к изменению состава вещества и образованию новых веществ с новыми свойствами. Они могут происходить под воздействием различных факторов, таких как температура, давление, влажность и др.
Какие основные виды химических явлений существуют?
В химии выделяют несколько основных видов химических явлений: реакции синтеза, реакции разложения, реакции замещения, реакции окисления-восстановления и реакции образования осадков.
Можете привести примеры химических явлений?
Конечно! Некоторыми примерами химических явлений являются: сгорание древесины, реакция образования ржавчины, синтез аммиака из азота и водорода, реакция окисления жира при приготовлении пищи и т.д.
Как можно проявить химическое явление в быту?
Химические явления встречаются в повседневной жизни каждого человека. Например, проявлением химического явления может быть изменение цвета кожи под воздействием солнечных лучей, переваривание пищи в желудке, окисление пищи при ее готовке и многое другое.